Вы не зашли.
Объявление
"Давайте только проявлять больше внимания, терпимости и уважения к чужому мнению — вот и всё." — Gennadius.
— О размещении изображений на форуме, О рекламе на форуме
#1 24 January 2013 00:22:51
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Гидрохимия
Здесь предлагаю обсуждать различные проблемы с составом воды наших аквариумов.
Вот у меня возникла проблема, которую мне очень лень решать )
Купил галечный грунт, запустил новый аквас на 150 л, но не учел, что грунт содержит окатанные фрагменты морских раковин. Сначала все было нормально, но сегодня сделал тесты на тетровских полосках - результаты жуткие:
рН - 8
кН - 20
gH - 14
И это при том, что у нас мягкая, почти дождевая вода в водопроводе.
Что можно сделать, чтобы воду умягчить, кроме вытаскивания грунта? - Мне очень в лом это делать, растения уже начали неплохо разрастаться, если их сейчас повыдирать - еще 2 месяца будут приниматься.
Я не хочу снимать жесткость до нуля, но хоть до
рН - 6
кН - 10
gH - 5
можно опустить как-то?
Неактивен
#2 24 January 2013 12:59:53
- AlRus
- Гость
Re: Гидрохимия
Вообще-то тесты полоски - не та вещь, которой надо проверять гидрохимию. Врут безбожно. Использовать лучше тесты капельные. И результаты какие-то странные. кН получается больше gН. Не должно быть такого, кН - карбонатная жесткость, определяется карбонатами кальция и магния. gН - общая жесткость, определяется всеми солями кальция и магния, в том числе и карбонатами.
#3 24 January 2013 15:48:16
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
AlRus, спасибо за ответ и пояснение!
Теперь понятно, что полоски - "вещь в себе". Нужно будет купить капельные тесты, но я не знаю, сколько они стоят и чьего производства лучше брать. А пока есть только тетровские полоски.
Правильно ли понимаю, что кН - карбонатная жесткость - это т.н. "временная жесткость". которая может меняться в зависимости от физических условий и снижаться многочасовым кипячением воды?
А gH - это неизменная жесткость и снижению не подлежит никаким образом? Или наоборот?
И еще - нейтральная вода, которая умеренно устраивает абсолютное большинство аквариумных рыб, это такая:
рН - 6,5
кН - 5
gH - 5
?
Просто у меня странно - апистограммы рамирези живут, вроде, хотя они мягководные, а недавно купленные мальки обыкновенного анциструса погибли, хотя кольчужные сомы должны быть более устойчивы к жесткой воде, если я правильно понимаю.
Может, им просто с непривычки стало плохо? Но апистограмм я тоже недавно купил, правда они уже взрослые, а не мальки.
Неактивен
#4 24 January 2013 16:00:23
- AlRus
- Гость
Re: Гидрохимия
Тесты капельные есть почти у всех известных аквариумных фирм - Тетра, Сера и др. Они неплохие, но довольно дорогие. Дешевле капельные тесты Нилпа, но на них довольно много нареканий, хотя, ИМХО, они все равно лучше полосок.
Про кН и gН все правильно, так и есть.
Для большинства аквариумных рыб границы нормы по воде шире, чем вы написали:
рН - 6 - 7,5
кН - 5 - 9
gH - 7 - 12
NO2 - ~20 - 30
Хотя это идеал, в реальности оказывается, что рыба - существо достаточно живучее и приспосабливается ко многому. Главное, что бы изменения были постепенными.
С апистограммами вам повезло - они часто не очень хорошо реагируют на смену условий. А почему так вышло с анциструсами - сложно сказать - могло быть всякое, не исключено, что они изначально были не особо жизнеспособны.
#5 24 January 2013 16:19:47
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Спасибо!
Вот, все же не зря тема завелась - можно будет как справочник использовать ![]()
Анцы, видимо, действительно были полудохлыми - ну и стоили по 25 руб, соответственно. Вчера увидел уже полуобглоданный скелетик одного из их мальков в лапах у стеклянной креветки.
Не думаю, что она могла их убить, клешни все же маловаты. Скорее всего, подобрала труп погибшего от недопустимой химии воды.
Неактивен
#6 25 January 2013 04:32:37
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
AlRus, не подскажете, вот такой торфяной препарат действительно смягчает воду?
http://aquapiter.com/product/substraty- … iv-1000-ml
Если да, то как это происходит, каким образом сокращается количество солей кальция и магния при добавлении торфа в фильтр? Ведь именно это нужно для смягчения воды - удалить соли металлов, так?
Неактивен
#7 25 January 2013 14:33:00
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
Miracinonyx :
Здесь предлагаю обсуждать различные проблемы с составом воды наших аквариумов.
...
рН - 8
кН - 20
gH - 14
...
Ваши тесты врут.
AlRus :
...И результаты какие-то странные. кН получается больше gН. Не должно быть такого, кН - карбонатная жесткость, определяется карбонатами кальция и магния. gН - общая жесткость, определяется всеми солями кальция и магния, в том числе и карбонатами.
Такое запросто может быть, учитывая, что капельные тесты на карбонатную жесткость измеряют на самом деле не карбонатную жесткость, а щелочность.
AlRus :
Для большинства аквариумных рыб границы нормы по воде шире, чем вы написали:
...
NO2 - ~20 - 30
...
При таком нитрите вся рыба быстро отправится в течение нескольких минут в страну вечносвежего мотыля. Наверно, все-таки речь идет о NO3 - нитрАте.
Неактивен
#8 25 January 2013 18:44:53
- AlRus
- Гость
Re: Гидрохимия
Пардон, описАлся, действительно No3, нитрат.
Щелочность конечно оно может быть, но откуда она избыточная щелочность будет, если конечно в аквариум соды не сыпали.
А про торфяные препараты - не знаю, но, ИМХО, сильно они жесткость не снизят.
#9 25 January 2013 23:03:13
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Прекрасно - полосные бумажные тесты от "Тетра" - врут. Капельные тесты - измерают не уровень карбонатов, а щелочность.
Чем мерять??? Достоверно?
Неактивен
#10 26 January 2013 19:38:58
- AlRus
- Гость
Re: Гидрохимия
Да капельными все меряют. Для практических аквариумных нужд хватает. А многие вообще принципиально не меряют. Считают, что рыба сама приспособится.
#11 27 January 2013 10:06:51
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Привет.
Спасибо вам за совет все-таки, AIRus.
Вчера уже съездил на рынок и купил капельные тесты "Нилла". Они наши, но я не думаю, что у серы\тетры и прочих они хоть чем-то отличаются, действующее вещество одно и то же. В общем да, тесты-полоски на бубажках - это такое г-но... оказалось...
Вот по результатам замены 1/3 воды в аквариуме и замерам капельными:
========================================
2013-01-26
--------------
gH = 8 dgH
(general Hardiness = общая жесткость)
kH = 6 dkH
(karbonate hardiness = карбонатная жесткость, переменная, буфер рН, не допускать падения ниже 4 dkH, иначе возможны скачки рН и гибель рыб)
pH = 7,7
(норма для большинства аквариумных рыб 6,5-7,7. Ровно 7 - нейтральная вода, ниже - кислая, выше - щелочная)
В общем, все нормально, только реакция чуть щелочная, что странно при низком уровне карбонатов кальция.
И еще можете поздравить - я купил первый в своей жизни внешний фильтр ))))))))))))
Неактивен
#12 28 January 2013 12:39:47
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
AlRus :
Пардон, описАлся, действительно No3, нитрат.
Щелочность конечно оно может быть, но откуда она избыточная щелочность будет, если конечно в аквариум соды не сыпали.
Очень многие люди, сами того не подозревая, "сыпят соду". Типичный пример: бытовые фильтры умягчители. Особенно, если это фильтр кувшинного типа с картриджем-умягчителем, типа "Барьер".
Miracinonyx :
Прекрасно - полосные бумажные тесты от "Тетра" - врут. Капельные тесты - измерают не уровень карбонатов, а щелочность.
Чем мерять??? Достоверно?
Заметьте: я не сказал, что капельные тесты не измеряют уровень карбонатов. Я сказал, что они измеряют уровень щелочности. А карбонаты (но не карбонатную жесткость!) они как раз мерят точно. Только карбонаты могут быть представлены не только гидрокарбонатами кальция и магния, но и другими металлами. Например, чаще всего сумятицу в измерения вносит гидрокарбонат натрия. Он - тоже гидрокарбонат. Его тоже измерит капельный тест на карбонатную жесткость. Но он не входит в карбонатную жесткость, поэтому результат измерения будет ошибочен.
Вообще, если позволите, чтобы какую-то ясность внести, положу сюда перепост моего же поста с другого ресурса:
---------------------------
1. Минерализация воды. В воде растворено очень много всего. И существует несколько общепринятых показателей, характеризующих это "много чего", сколько его растворено в воде. Первое, что используется из таких показателей - это жесткость. Этот показатель характеризует, сколько в воде растворено солей магния и кальция. Соли магния и кальция (их объединяют, потому что они очень похожи по своим свойствам) бывают двух видов:
- карбонаты (/бикарбонаты), которые в воде в растворенном виде представлены в виде гидрокарбонатов
- прочие соли магния и кальция.
Так вот, количество растворенных в воде солей первой группы характеризует показатель - временная (карбонатная) жесткость. (kH) измеряется в немецких градусах. Временной (или еще переменной) жесткостью ее называют, потому что например при кипячении растворенные в воде гидрокарбонаты переходят в нерастворимую форму - карбонаты, которые весело высыпают в виде накипи на ваших чайниках и кастрюлях и выводят из строя посудомойки. Таким образом, с помощью кипячения можно снизить эту жесткость. Постоянная же жесткость (gH) характеризует содержание ВСЕХ соединений магния и кальция (включая и гидрокарбонаты). Тоже считается в немецких градусах жесткости. Нетрудно заметить, что
gH = kH + некарбонатная жесткость (т.е. все соединения кальция и магния, кроме карбонатов).
*
Небольшое отступление
Нетрудно также заметить, что постоянная жесткость gH всегда больше или равна карбонатной жесткости кН. Но, если взять аквариумные капельные тесты и измерить эти величины, то иногда случаются ситуации, что результаты тестов показывают, что кН превышает gH. Казалось бы, это невозможно! Это связано на самом деле со способом замера этих величин. Дело в том, при измерении содержания гидрокарбонатов кальция и магния тесты измеряют не количество ионов магния и кальция, а содержание гидрокарбонатной группы. Потому, что в естественных условиях подавляющее большинство гидрокарбонатов в воде представлены обычно гидрокарбонатами кальция и магния, то измеряя гидрокарбонатную группу, просто считают, что она относится к кальцию или магнию. Ну это как на вопрос "На сколько человек этот автобус?" вы посчитаете по пустым креслам, а не по людям, и дадите ответ. А на самом деле, на каком-то из кресел может сидеть и собака. Я подчеркиваю еще раз - в естественных условиях. Но к примеру, с такой ситуацией могут столкнуться владельцы загородных домов, у которых индивидуальные скважены и установлены умягчители, а именно натрий-катионовые умягчители воды. Смотрите: натрий-катионовый умягчитель - это баллон, внутри которого ионообменная смола. Вода при прохождении через эту смолу отдает в смолу за два иона натрия по иону кальция или магния. Таким образом на выходе после умягчителя все та же вода, все с тем же количеством солей, все с теми же гидрокарбонатами, но вот только это уже не гидрокарбонаты кальция или магния, а гидрокарбонаты натрия, которые не входят в карбонатную жесткость, не выпадают в виде нерастворимых карбонатов при кипячении и не способны вывести из строя стиральную машину. Что же покажут тесты в этом примере? До умягчителя, например, кН=6, gH=12, после умягчения, например, тесты покажут кН=6, gH=0. Парадокс? Нет. Еще раз: тест на кН измеряет на самом деле количество гидрокарбонатов (щелочность), а они теперь представлены исключительно гидрокарбонатами натрия, которые не должны учитываться в расчете кН. Это означает, что на самом деле кН=0, а разницу якобы превышения кН над gН называют мнимой жесткостью. Между прочим, многие бытовые фильтры типа "Барьер" и т.п. используют тот же принцып. Потому владельцы могут столкнуться с той же проблемой
*
Чаще всего тот налет на стеклах террариума - это и есть карбонаты кальция и магния, которые перешли в нерастворимую форму карбонатов из гидрокарбонатов, растворенных в воде.
2. Способы снижения жесткости. Строго говоря, можно перечислять все эти "вымораживание, кипячение" и т.п. Но это все мало применимо к практике использования. Нас больше интересуют здесь, что такое дистилят, осмолят, и в чем разница между ними.
Дистилят - это вода с определенными параметрами, прежде всего жесткости, получаемая методом дистиляции, т.е. перегонки воды. А вот тут внимание(!). Дело в том, что на выходе получается практически чистая вода, без примесей. При этом существует ГОСТ, определяющий допустимое содержание солей в дистилляте. Т.е., строго говоря, уже становится не так важно, КАК была получена эта вода. Если по своим характеристикам она укладывается в ГОСТ, то ее можно смело называть дистиллятом. Ну кого волнует, как была получена эта вода? Главное - что это именно она по характеристикам. Потому происходит уже подмена понятий: дистиллятом называют часто не по методу получения, а по соответствию установленному ГОСТУ. Так, насколько я помню, ГОСТ устанавливает, что электропроводность дистиллированной воды (вот даже не парьтесь, что это означает. Электропроводность - это способность воды проводить электрический ток. А проводимость воды определяется количеством растворенных в ней солей. Другими словами, электропроводность характеризует количество солей, по аналогии с жесткостью)
не более 5 мксм на см. Заметьте: все утверждения, что дистилированная вода - "мертвая вода", т.е. ничего не содержит, мягко говоря, неправда. Содержит, да еще и как - те самые 5 мксм на см. Можете погуглить ГОСТ, если сомневаетесь.
Теперь осмолят. Осмолят - это вода, прошедшая через фильтр с обратноосмотической мембраной. Если говорить упрощенно, обратноосмотическая мембрана - это сито с очень мелкой ячейкой, через которую в состоянии пройти молекула воды, но не проходят различные прочие вещества. Степень очистки такого фильтра потрясающ. По сути на выходе отсекается более 90% того, что было растворено в воде на входе. Заметьте, что в отличие от дистиллята, который определяется ГОСТом, осмолят - это лишь разговорное название воды, прошедшей очистку мембраной. Т.е. разные мембраны - разная степень очистки. Никаких жестких требований нет.
А теперь, чтобы мозг не взрывать. Для сравнения, результаты моих замеров:
1. Вода из крана (т.е. в магистрали) у меня дома: кН=6, gH=13, электропроводность 400-450 мксм на см. Кто-то тут говорил, что московскую воду из крана можно лить смело? Нальете такую в фоггер или в дождевалку, можете с ней попрощаться скоро.
2. Вода - дистиллят. кН=0, gH=0, электропроводность 3-5 мксм на см.
3. Вода осмолят у меня на выходе после фильтра осмотической очистки. кН=0, gH=0, электропроводность 20-25 мксм на см.
Обратите внимание: как жесткая вода (1) осмосом превращается в практически не содержащую соединений воду (3), которая по характеристикам практически (разница по электропроводности составляет всего 20 мксм на см, этим можно пренебречь) одинакова с дистиллятом.
2. Влияние минерализации на организм. Нет никаких сомнений, что организм нуждается в пополнении минералами. Вот только то, как будет пополняться, организму без разницы. Если существо (в т.ч. и человек) ест много чего другого, что содержит соли и минералы, то без разницы, какую воду оно будет пить. Пусть хоть дистиллят пьет, никаких проблем это не вызовет. Лично я вот довольно неплохо себя ощущаю, при этом пью исключительно в качестве простой воды осмолят и не жужу. С человеком несколько проще все же, потому как он ест такое разнообразие разной дряни, что за содержание минералов можно не беспокоиться. Отчасти миф об опасности дистиллята/осмолята для организма - маркетинговый ход. Производители обратноосмотических фильтров довольно удачно продают свои реминерализаторы, которые устанавливаются на выходы фильтров и обратно наполняют воду карбонатами. Вот такая туса: вы покупаете фильтр, покупаете ремнерализатор. Первый удаляет карбонаты из воды, второй туда же их добавляет. При этом мембрана постепенно выходит из строя, и вы снова идете к производителю, чтобы купить мембрану для замены.
Замечу также, что по сути дождевая вода=осмолят=дистиллят. Не верите? Возьмите тесты и сделайте замеры сами. Замечу, что дождь - это результат гигантского дистиллятора - нашей планеты. При этом в дождевой воде довольно неплохо живут куча рыб, животных. Ее пьют. Амазонские затопляемые леса игапо - это сплошные озера дистиллята. При этом нигде больше нет такого разнообразия рыб.
3. Про злобные бактерии.
Мы среди них. Они повсюду. От них нельзя избавиться никак. Уничтожив в воде бактерии с помощью УФ лампы, вы тут же их получаете в ближайшей кастрюле, куда налили воду. Потому бороться с ними - бесполезное занятие. Их к тому же огромное разнообразие.
Здесь важно понять, что же "портит" вашу воду. Начнем с того, что воду "испортить" нельзя. В ней, в условиях террариума, может начать накапливаться различная органика, производными от которых являются соединения азота. Прежде всего - это аммиак или его ион - аммоний. И тот и другой в равной степени тксичны для всего живого. Нашатырь нюхали? Это и есть аммиак. Иногда нашатырем пахнет водоем - явный признак избыточности аммиака. Так вот, здесь нужно пояснить основу биологической фильтрации водоема, а именно - цикла нитрификации. Под нитрификацией понимают процесс окисления в присутствии аэробных бактерий соединений азота от наиболее токсичного аммиака через нитрит до менее токсичного нитрата.
*Как это выглядит.
Сначала в воду попадает органика, производной от которой в воде появляется аммиак (NН3) или аммоний (NH4+). Аммиак является по сути едой для бактерий рода Nitrosomonas. И с увеличением количества этой еды растет также и колония этих бактерий. Они начинают размножаться. При этом эти бактерии в аэробной среде окисляют аммоний и аммиак до нитрИта (NO2), который так же ядовит для всего, как и аммиак. В какой-то момент времени бактерии расплодятся настолько, что жрачки больше не будет хватать для дополнительной колонии. Весь производимый водной системой аммиак будет под ноль перерабатываться данной колонией бактерий в нитрит. Наступает аммиачный пик. Если это изобразить на кривой, где по горизонтали время, а по вертикали - количество аммиака, то вы получите гору. Ее вершина - и есть этот аммиачный пик.
Замечу, что Nitrosomonas перерабатывают аммиак в нитрИт, при этом еще и колония растет. Таким образом в воде появляется все больше и больше нитрИта. А вот нитрИт служит жрачкой для другого вида бактерий - бактерий рода Nitrobacter. Эти бактерии в присутствие кислорода окисляют нитрит (NO2) до нитрАта (NO3), который уже в десятки раз менее токсичен для всего живого и не имеет уже запаха. Эти бактерии по аналогии начинают плодиться, колония начинает расти и в какой то момент времени их становится столько, что нитрита больше не хватает для роста колонии. Если на той же шкале нарисовать на том же времени количество нитрита, то вы получите вторую гору, слегка справа от первой. И ее вершина - нитритный пик. А в целом вся диаграмма будет выглядеть как перевернутые сиськи.
Через пару дней после нитритного пика показатели нитрита упадут в ноль и наступит равновесие, когда вся производная водоемом органика полностью перерабатывается в менее токсичный нитрат. Замечу, что все эти бактерии обитают на субстрате, а не в толще воды. Потому чем более пористый субстрат, т.е. бОльшая поверхность соприкосновения с водой, тем более эффективная работа бактерий. А весь процесс вместе называется биологическая фильтрация
*
Таким образом что нужно на практике, чтобы водоем оставался "чистым"? Нужно запустить процесс биологической фильтрации, а для этого надо, чтобы весь объем воды приводился в движение, протекал через какой-л субстрат, который сами заселят бактерии-нитрификаторы. При наступлении равновесия вы получите воду, свободную от таксичных производных органики. Замечу, что в результате нитрификации вы в воде получаете нитраты. Они хоть и в десятки раз менее токсичны для живого, но все же в высоких концентрациях могут вызывать отравления. Поэтому можно использовать три способа очистки вашего водоема от нитратов:
1. Регулярно просто меняйте воду.
2. Для извращенцев - поставьте денитрификатор. Д. - это такое устройство, которое содержит субстрат с денитрифицирующими бактериями, которые в анаэробной среде, используя для питания уже не кислород, восстанавливают нитраты до газообразного азота, который - фьють! - улетучивается.
3. Посадите живые растения. Нитрат - основное питательное вещество для растений. Ботва будет переть как на дрожжах. Заодно и избавит вас от нитратов. Именно на этом построен принцип действия фитофильтров.
Есть еще химические способы очистки воды от нитратов, но их тоже для извращенцев можно оставить.
Неактивен
#13 28 January 2013 12:53:19
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
Miracinonyx :
Привет.
Вчера уже съездил на рынок и купил капельные тесты "Нилла"...
Вот по результатам замены 1/3 воды в аквариуме и замерам капельными:
========================================
2013-01-26
--------------
gH = 8 dgH
(general Hardiness = общая жесткость)
kH = 6 dkH
(karbonate hardiness = карбонатная жесткость, переменная, буфер рН, не допускать падения ниже 4 dkH, иначе возможны скачки рН и гибель рыб)
pH = 7,7
(норма для большинства аквариумных рыб 6,5-7,7. Ровно 7 - нейтральная вода, ниже - кислая, выше - щелочная)
В общем, все нормально, только реакция чуть щелочная, что странно при низком уровне карбонатов кальция.
Ну, во-первых, это не низкий уровень карбонатов, и рН совершенно соответствует данному кН.
Во-вторых, на самом деле, что дает вам знание об этих параметрах? Весь вопрос в том, что вы хотите содержать у себя в аквариуме.
Рыбам вообще по барабану кН и gН. рН им тоже бо балде, главное, чтобы этот показатель не менялся быстро (он же все-таки лагорифмический).
Многим беспозвоночным, моллюскам важен кН, а в частности, карбонат кальция, поскольку им необходим кальций для строительства раковин, линьки и т.п. Если у вас таких жильцов нет, то вам пофиг на этот показатель.
Растениям пофиг на gН и рН, по большому счету. Но важен кН, а точнее гидрокарбонатный буфер, а еще точнее способность воды связывать свободные ионы водорода. Это я к тому, что даже если у вас там в воде гидрокарбонат натрия, а гидрокарбоната кальция нет вообще (т.е. например, результаты теста показывают gН=0, кН=15), т.е. строго говоря, карбонатная жесткость равна нулю, то карбонатный буфер от гидрокарбоната натрия будет работать так же, как и обычный гидрокарбонатный буфер при обычной карбонатной жесткости (как если бы карбонатная жесткость на самом деле была равна 15). А этот показатель важен прежде всего для того, чтобы контролировать концентрацию растворенной углекислоты в воде. Очевидно, что для успешного роста растений надо:
1. Свет
2. Углекислота
3. Макроэлементы (азот, фосфор, калий)
4. Микроэлементы.
Если у вас концентрация углекислоты недостаточна, то остальные элементы (3-4) не будут потребляться растениями, зато будут весело потребляться водорослями, что неминуемо приведет к водорослевой вспышке.
Неактивен
#14 29 January 2013 23:04:14
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Спасибо за информацию. Сохраню себе в качестве краткой справки по аквариумной гидрохимии.
Неактивен
#15 19 March 2013 22:41:09
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
kokon2208 :
Я вроде не советовал никогда API. Хотя, это неплохие тесты. Если бы я советовал, то аквариум фармасьютеклз. Но не суть важно, апи тоже неплохо работают.
Гм. Вообще API = Aquarium Pharmaсeuticals Incorporated, разве нет? - Мне так сказали в салоне на кондрашке, когда я спрашивал про лекарства "фармасьютикалз", и потом еще один человек подтвердил. На упаковке ничего нет.
Вы писали
рН задран до 7,8-8 градусов
А теперь пишите
pH ~7,3 API
Это колоссальная разница. Вы понимаете, что шкала рН логарифмическая, т.е. разница между рН 7.3 и 7.4 в 10 раз, а между 7.3 и 7.8 в миллион раз? рН=7.3 как раз нормальна для кН=2-3. Достаточно врубить аэрацию, как вы получите такое значение. кН воды в кране и в аквариуме не должны отличаться, если нет извести в банке. А вот рН при такой жесткости легко может быть как 6.5, так и 7.3. Но имхо у вас тесты при тестировании именно воды из крана врут. Померьте одним и тем же тестом подряд воду из крана и в банке.
Именно так и делаю - при тестировании обоих аквариумов затем тестирую и воду из водопровода и воду из фильтра, разница в 5 минут, точность замеров одинаковая.
Вот на 18 марта сего года.
Фильтр
Март 10 Март 18
pH 10 Нилпа 6,7 API
gH (dgH) 2 2
kH (dkH) 2 2
РО3-(мг/л) - -
Водопровод
Март 10 Март 18
pH 6 Нилпа 6,4 API
gH (dgH) 3,3 2,5
kH (dkH) 1,5 1,5
РО3-(мг/л) - -
Аква 200 л
Март 10 Март 18
pH 7,5 Нилпа 7,6 API/7,4 Нилпа
gH (dgH) 8 6,8
kH (dkH) 6 5
РО3-(мг/л) 0,3 0,7
Аква 50 л
Март 10 Март 18
pH 8 Нилпа 7,5 API/6,8 Нилпа (?)
gH (dgH) 6 3,5
kH (dkH) 4 2,5
РО3-(мг/л) < 0,1 < 0,1
И еще вопрос, Кокон - тесты дают цветовые реакции в воде. Я подозреваю, что у меня может быть нарушено тонкое цветовосприятие и не всегда уверенно отношу полученный цвет раствора к той или иной графе прилагаемой цветной таблицы. Правильно ли понимаю, что тесты могут показывать и промежуточную жесткость (например, у АПИ цифровые значения таблицы идут так: 7,2; 7,5; 7,8. - При этом мне кажется, что тест показывает оттенок между двумя соседними графами - значит именно так и есть? - Т.е. не 7,2 или 7,5 а, скажем, 7,4? Несмотря на разницу на порядки?
И еще один вопрос - тесты на рН предполагают, что раствор должен рывком окраситься из розового в зеленый. При этом в реальности выходит, что рывком он теряет розовый оттенок, но он становится просто серым. Зеленый цвет формируется только после добавления еще капель 5-7. Границей нужно считать потерю розового (как я предварительно принял для себя)? Или приобретение выраженного зеленого?
Отредактировано Miracinonyx (19 March 2013 22:44:22)
Неактивен
#16 19 March 2013 23:37:31
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
Судя по тому, что вы написали, нилпа показывает стабильно какую-то хню.
Фильтр: при кН=2 нормальный рН будет 6.6-7 в зависимости от движения воды, но НИКОГДА не будет 10
Водопровод: при кН=1.5 норма для рН будет те же 6.5-7, также зависит от движения воды, но НИКОГДА не будет 6 без дополнительной искусственной подачи углекислоты
Аква 200л: при кН=5-6 норма для рН будет 7.3-7.6 в зависимости от интенсивности движения воды
Аква 50л: при кН=2.5-4 норма для рН будет где-то 6.7-7.1, но НИКОГДА не будет 8.
Тесты показывать промежуточную жесткость не могут. Жесткость определяется титрованием раствора, т.е. строго определяется момент изменения цвета раствора по количеству капель. А вот по шкале рН вполне себе оттенки могут быть разными, кроме того, сама шкала может быть трудночитаемой, потому запросто можно получать ошибочные, "промежуточные" значения, либо крайние. Тут навык нужен. Но при этом что важно: не так это важно - это небольшое отклонение и не оказывает существенного влияния. Раствор при тесте на рН "рывком" окрашиваться не должен. У меня ощущение, что вы путаете тесты на рН и кН (gН) это тесты на жесткость определяют величину по смене окраса раствора при количестве капель реагента. А тесты на рН обычно просто предполагают добавить 3 (иногда 5) капель раствора и подождать, в какой цвет все окрасится. При этом раствор потом не меняет своего цвета.
Неактивен
#17 20 March 2013 01:02:51
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Раствор при тесте на рН "рывком" окрашиваться не должен. У меня ощущение, что вы путаете тесты на рН и кН (gН) это тесты на жесткость определяют величину по смене окраса раствора при количестве капель реагента. А тесты на рН обычно просто предполагают добавить 3 (иногда 5) капель раствора и подождать, в какой цвет все окрасится. При этом раствор потом не меняет своего цвета.
Да, конечно, я сформулировал вопрос безграмотно. Имелось в виду, что я плохо определяю точную цветовую градацию в растворах с тестами на рН.
А по поводу "окраски рывком" и что считать моментом перехода - потерю розового цвета или набор выраженного зеленого - это речь шла о тестах на gH и kH, конечно.
Вы можете привести формулу расчета, из которой следуют предельные значения рН при том или ином значении кН? - Вы ведь это каким-то образом оценили, значит есть способ?
Насчет Нилпы - увы, похоже, что тесты фиговые. Во всяком случае на рН.
Странно это. Даже такую мелочь не могут сделать нормально.
Неактивен
#18 20 March 2013 21:54:18
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
нет, не могу. Ее просто нет. Я говорю лишь из опыта, по памяти, исходя из таблиц углекислотного равновесия. Вот такой таблицы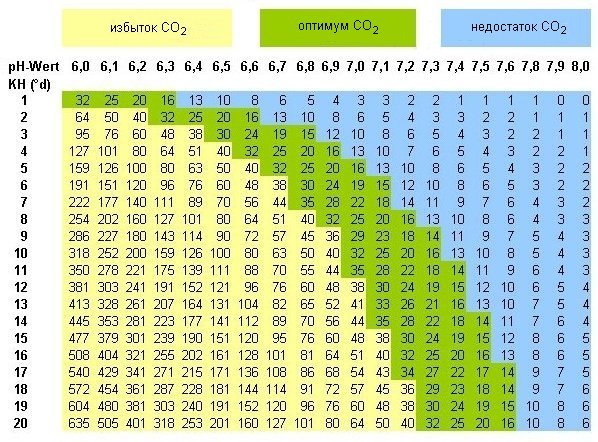
Водопровод
Март 10 Март 18
pH 6 Нилпа 6,4 API
gH (dgH) 3,3 2,5
kH (dkH) 1,5 1,5
РО3-(мг/л) - -
Водопровод: при кН=1.5 норма для рН будет те же 6.5-7, также зависит от движения воды, но НИКОГДА не будет 6 без дополнительной искусственной подачи углекислоты
Вот на примере. кН =1.5 означает, что равновесное содержание углекислоты будет давать рН от 6.5 (при 10 мг на л углекислоты) до 7 (при 3 мг на л). 7 можно получить только интенсивно аэрируя воду, чтобы удалить из воды углекислоту, которая образует угольную кислоту и понижает рН. Либо если в аквариуме много растений при ярком свете, которые потребляют интенсивно углекислоту. Легко из таблицы убедиться, что рН=6 при таком кН получить без специальных устройств растворения углекислоты невозможно. Это ЗА пределами равновесия. При этом если достичь при этой кН такого рН, то вы получите около 50 мг на л растворенной углекислоты, что УБЬЕТ все живое в воде. Это за границей смертельной дозы. Ну, как-то так, но я писал выше по памяти, и из собственного опыта.
Неактивен
#19 20 March 2013 22:00:46
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Спасибо большое.
Неактивен
#20 20 March 2013 22:02:25
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
Если вам не понятно по-прежнему, то попроще объясню. В обычном московском аквариуме, где нет мощного света и густых растений, в подавляющем большинстве случаев смотрите равновесное состояние там, где указано примерно 10 мг на л растворенной углекислоты. Например, при кН=6 рН=7.3, как я раньше уже писал
Аква 200л: при кН=5-6 норма для рН будет 7.3-7.6 в зависимости от интенсивности движения воды
При этом исходите из того, что это скорее минимальное значение рН для равновесного диапазона. Добавим растения - получим увеличелния рн. Включим аэрацию - снова увеличим рН. Грубо конечно, но как-то так это работает.
Неактивен
#21 20 March 2013 22:11:15
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Просто не понятно было, где находится зона равновесия. Вы говорите - это около 10 мг СО2 на 1 л воды. Из таблицы этого никак не видно, но спасибо, что теперь сказали.
Единственное, что мне лично не ясно, почему не происходит дополнительного растворения СО2 из воздуха, когда его высасывают растения?
По-идее, все должно колебаться всегда возле точки равновесия. Если это 10 мг/литр - то значит возле нее.
А как аэрация может удалить СО2 из воды вообще не ясно, если учесть, что углекислый газ растворяется гораздо лучше кислорода и при аэрации именно им должна насыщаться вода в первую очередь. (я не спорю с вами, просто эти моменты действительно не понятны).
Неактивен
#22 20 March 2013 22:17:34
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
Так и есть. По мере того, как растения выжирают углекислоту, она растворяется, диффундируя через поверхность. Но скорость растворения ее ниже, чем скорость потребления растениями. Потому в аквариумах, где низкий кН часто можно наблюдать вполне естественное явление: утром после включения света рн начинает медленно расти и достигает своего пика к вечеру. Затем свет выключают, и рН начинает падать, достигая своего низа под утро. 10 мг на л - это примерное равновесие, которое я наблюдал на собственном опыте. У кого-то это может быть и 7 мл, зависит от аээрации, течения, количества растений. Но (!) ни у кого не будет при кН=6 15 мг на л (значение из центральной зеленой полосы). Это уже достижимо только при специальном растворении углекислоты.
Все верно, углекислота не только легко растворяется, но еще более легко улетучивается при интенсивном движении воды.
Неактивен
#23 20 March 2013 22:23:42
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Кокон, а каким образом вывели этот "оптимум" содержания СО2, если он недостижим естественным путем? Что это за оптимум такой, который удается поддержать только искусственно вмешиваясь в систему? И что такое "эффект" колокола в природных водоемах? - Понятно, что там глубина мизерная по сравнению с площадью поверхности, но разве там не точно те же самые 10 мг/литр, что и в аквариуме без ухищрений?
Неактивен
#24 20 March 2013 22:34:29
- kokon2208
- Любознательный
- Зарегистрирован: 04 July 2012
- Сообщений: 83
Re: Гидрохимия
этот "оптимум" - это для растений. Т.е. это максимально возможные растворенные количества углекислоты (которая необходима растениям для фотосинтеза), при которых не загибаются другие гидробионты от углекислотного отравления. Вся желтая зона - зона смерти. Вся синяя - слишком мало углекислоты для роста растений. Зеленую зону в обычных условиях аквариума получить практически невозможно без искуственной подачи углекислоты. Вообще не забывайте, что большинство аквариумных растений на самом деле болотники. И под водой растут лишь частично. Поэтому, раз уж их утопили, то их надо снабдить всем необходимым для роста ТАМ. Углекислота - одно из условий. Некоторые растения (как элодея) приспособились к жизни под водой, извлекая углекислоту напрямую из гидрокарбонатов. Потому без проблем могут жить в воде постоянное при низкой концентрации углекислоты.
Реактор типа колокол - это, по сути, стакан, перевернутый вверх дном под водой. Вы подаете в него углекислоту, создаете в нем большую концентрацию, и та диффундирует в воду через водораздел. На самомо деле именно так и растворяется в обычных прудах углекислота из атмосферы. Но тут как раз очень эффективный колокол - площадь водораздела огромна по отношению к глубине. А вот в искуственном колоколе в аквариуме малая площадь компенсируется большой концетрацией.
Неактивен
#25 20 March 2013 22:55:44
- Miracinonyx
- Любитель животных

- Зарегистрирован: 05 December 2006
- Сообщений: 19226
Re: Гидрохимия
Спасибо за разъяснения!
Задам вопрос в "Оборудовании".
Неактивен